삼성융합의과학원 김정훈 교수 연구팀,
암 특이적 유전자발현 증가시키는 핵심 조절자 찾아내
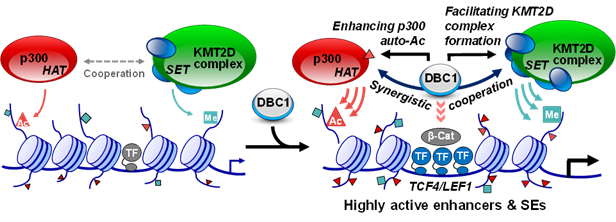
▲암세포 특이적 슈퍼인핸서의 후성유전학적 조절기전 규명
삼성융합의과학원 융합의과학과 김정훈 교수 연구팀은 DBC1 단백질이 대장암 진행에 특화된 슈퍼인핸서(super-enhancer)의 형성에 중요한 역할을 하여 암 특이적 유전자발현을 증가시킨다고 밝혔다. 또한 이에 대한 분자기전으로 DBC1이 히스톤 H3K4 메틸화 효소(KMT2D)와 히스톤 H3 아세틸화 효소(p300)의 효소활성 증가시키는 핵심 조절자로서 역할을 한다는 사실을 보고하였다.
히스톤의 후성유전학적 변형은 크로마틴 dynamics와 유전자발현에 중요한 조절 기전이다. 하지만 히스톤 변형을 일으키는 후성유전학적 효소들의 활성을 조절하여 유전자발현을 미세조정할 수 있는 핵심 조절자는 거의 알려진 바가 없었다.
최근 김정훈 교수 연구팀은 DBC1이 후성유전학적 효소들의 활성을 조절할 수 있는 중요 활성체임을 지속 보고하였으며, 본 논문에서는 유전체 수준에서 히스톤의 후성유전학적 변형에 대한 DBC1의 역할을 규명하기 위해 Crispr/Cas9을 이용한 유전자 편집 기술과 차세대 염기서열 분석 기술을 이용하여 대장암세포에서 후성유전학적 전사조절 기전연구를 수행하였다.
연구팀은 DBC1에 의해 유전자의 전사활성을 나타내는 표식인 히스톤의 후성유전학적 변형들(히스톤 H3 단백질의 아세틸화와 메틸화)이 유전체 수준에서 조절된다는 사실과 히스톤 변형의 변화수준에 비례하여 종양 유전자들의 발현수준도 변화한다는 사실을 밝혔다. 이는 DBC1이 히스톤의 변형 및 유전자발현을 미세조정하는 핵심 조절자로서 역할을 한다는 것을 의미한다.
또한 다양한 암세포에서 유전자 발현조절 이상의 원인으로 작용하는 암세포 특이적 슈퍼인핸서의 형성에도 DBC1이 중요한 역할을 하며, 특히 대장암 진행의 주요 신호전달체계인 Wnt 신호전달에서 DBC1이 슈퍼인핸서의 형성을 유도한다는 분자기전을 규명하였다. 즉 DBC1은 후성유전학적 효소인 KMT2D 및 p300에 결합하여 상호작용을 촉진함으로써 대장암세포에서 암 특이 슈퍼인핸서의 형성 및 관련 유전자들의 발현을 증가시킨다는 사실을 밝혀냈다.
김정훈 교수는 “본 연구는 그동안 알려지지 않았던 히스톤 변형 효소들에 대한 핵심 조절자를 발굴하고 새로운 후성유전학적 전사조절 기전을 규명한 것에 의의가 있다”며 “대장암을 포함한 다양한 암종에서 DBC1을 후성유전학적 종양 치료표적으로 응용할 수 있을 것으로 기대된다”고 밝혔다.
본 연구는 한국연구재단의 지원으로 수행되었으며, 생화학 & 분자생물학 분야 세계적인 학술지인 ‘Nucleic Acids Research’ 저널(Impact factor: 19.16)에 2022년 8월 12일 게재되었다.
* DBC1 is a key positive regulator of enhancer epigenomic writers KMT2D and p300. Nucleic Acids Research, 2022 Aug 12, 50(14):7873-7888. DOI: https://doi.org/10.1093/nar/gkac585 (제1저자: 김화진; 교신저자: 김정훈; 공동저자:문수진, 홍상훈, 원홍희)

삼성융합의과학원 김정훈 교수(왼쪽), 김화진 연구원(오른쪽)